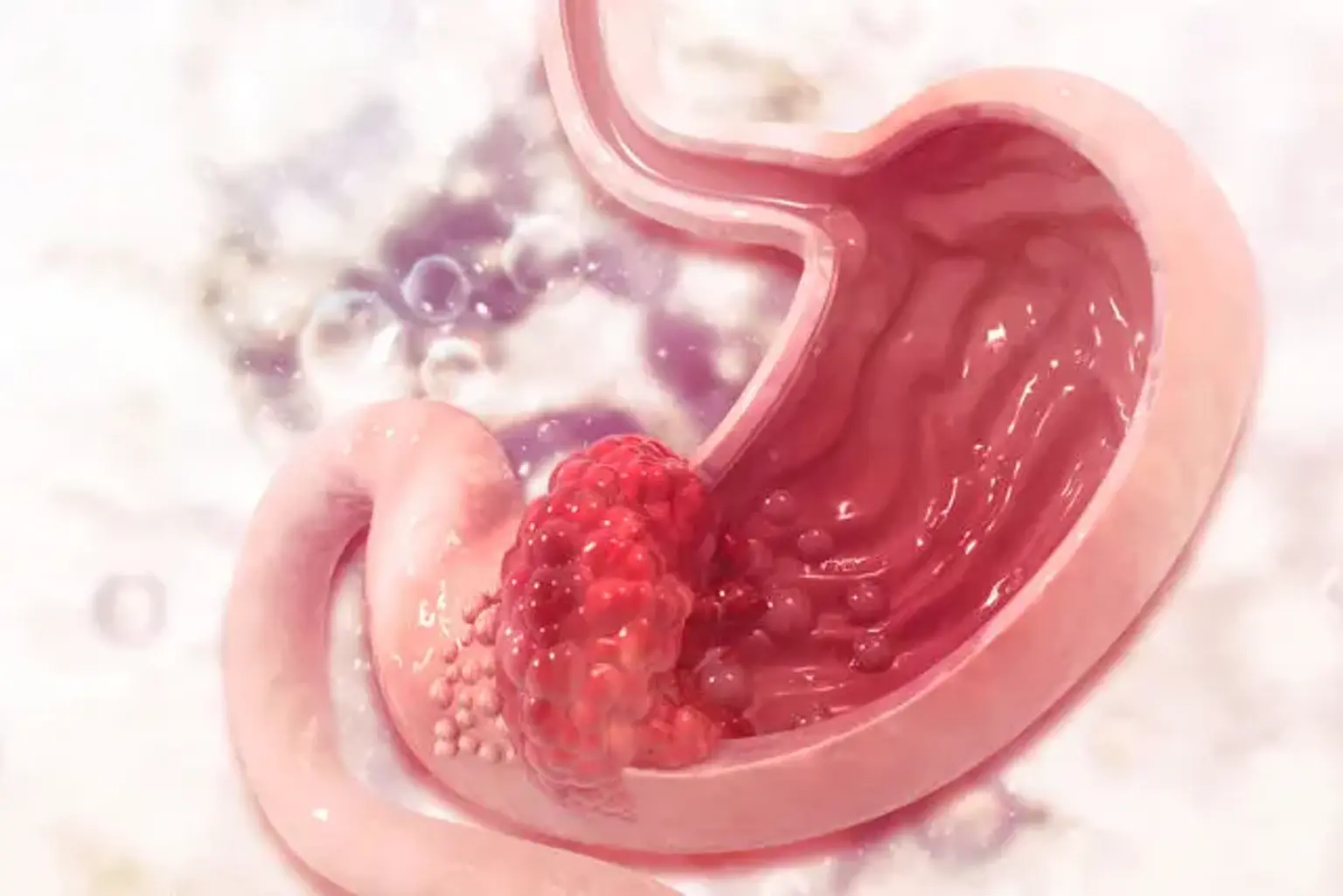
Câncer gástrico
Visão geral
O câncer gástrico é o quinto câncer mais comum e a terceira principal causa de mortes por câncer em todo o mundo, apesar de uma queda global desde meados do século. Nos Estados Unidos, a incidência de câncer de estômago caiu nas últimas décadas, enquanto a incidência de câncer gastroesofágico aumentou.
O adenocarcinoma gástrico é classificado em dois tipos: intestinal (bem diferenciado) e difuso (indiferenciado), cada um com sua própria aparência morfológica, etiologia e perfil genético. A ressecção cirúrgica com linfadenectomia apropriada é a única opção de terapia curativa possivelmente para pessoas com câncer de estômago.
A terapia perioperatória para aumentar a sobrevivência de um paciente é apoiada pela pesquisa atual. Lamentavelmente, para pacientes com doenças incuráveis, localmente avançadas ou metastáticas só podem ser prestados cuidados paliativos para prolongar a vida.